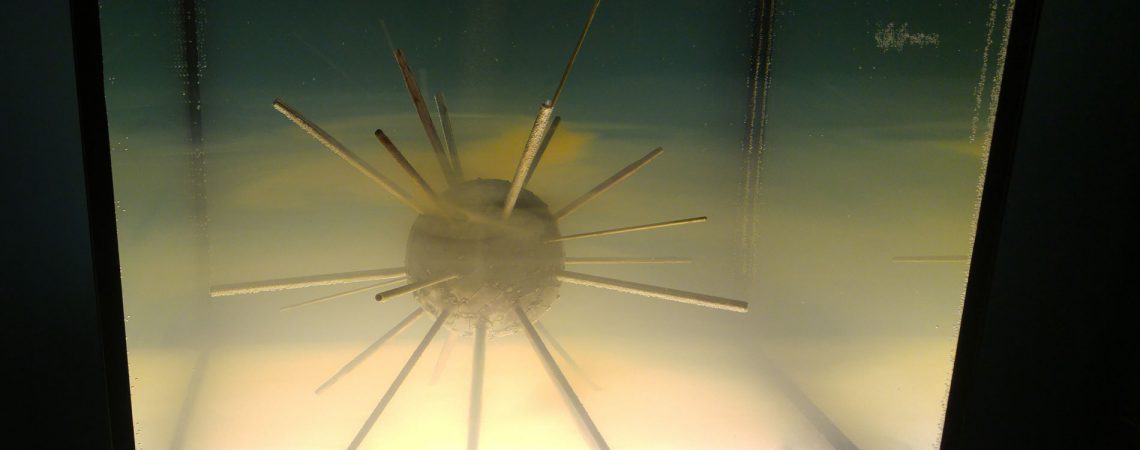
Eau de mer
Corps inconel
Tiges- cuivre, laiton, fer, aluminium
Chlorure de sodium (30g /l)
Le caractère corrosif de l’eau de mer est bien connu et liée à sa teneur élevée en sel (chlorure de sodium).Cependant, les réactions de base de la corrosion des métaux et alliages dans ces eaux de mer ne mettent pas directement en cause les chlorures présents.
(i) Les réactions d’oxydation diffèrent d’un métal à l’autre : pour l’aluminium Al → Al³⁺ + 3e⁻ , pour le fer deux réactions sont possibles Fe → Fe³⁺ + 3e⁻ ou Fe → Fe²⁺ + 2e⁻ , pour le cuivre de cuivre Cu → Cu⁺ + e⁻ ou Cu → Cu²⁺ + 2e⁻ , pour l’inconel qui est un alliage de nickel avec une forte teneur en chrome, la réaction d’oxydation du nickel s’écrit Ni → Ni²⁺ + 2e⁻ et celle du chrome : Cr → Cr³⁺ + 3e⁻ (dans nos conditions), et pour le laiton qui est alliage de cuivre et de zinc, les réactions d’oxydation du cuivre sont possibles ainsi que celle du zinc Zn → Zn²⁺ . Les cations métalliques ainsi produits peuvent soit former une couche d’oxyde qui limitera plus ou moins la corrosion du métal de base : c’est le cas du chrome dont l’oxyde Cr₂O₃ forme la couche passive qui protège l’inconel, soit réagir avec les anions présents pour former des hydroxydes, des chlorures qui précipitent dans la solution.
(ii) une réaction de réduction qui en début d’exposition est la réduction de l’oxygène selon la réaction O₂ + 2H₂0 + 4e⁻ → 4OH⁻ , et lorsque l’oxygène dissous dans la solution initiale sera consommé, sera la réduction de l’eau selon la réaction 4H₂0 + 4e⁻ → 4OH⁻ + H₂
L’ensemble est donc en totale évolution, que ce soit côté matériaux métalliques ou côté solution. De plus, certains alliages, s’ils sont bien couplés électriquement avec les autres, vont se corroder plus rapidement tout en protégeant les autres matériaux métalliques : l’aluminium puis le fer se corroderont plus vite tout en limitant la dégradation de l’inconel et du cuivre et du laiton… L’eau de mer va également évoluer : sa teneur en oxygène va diminuer car l’oxygène sera consommé par la réaction cathodique et cette l’évolution chimique inclura la précipitation des hydroxydes, oxydes et chlorures, ainsi que l’alcalinisation de la solution.